ALCOHOLES
Los alcoholes son compuestos que presentan en la cadena carbonada uno o más grupos hidroxi u oxidrilo (-OH).
Propiedades Físicas:
Las propiedades físicas de un alcohol se basan principalmente en su estructura. El alcohol esta compuesto por un alcano y agua. Contiene un grupo hidrofóbico (sin afinidad por el agua) del tipo de un alcano, y un grupo hidroxilo que es hidrófilo (con afinidad por el agua), similar al agua. De estas dos unidades estructurales, el grupo –OH da a los alcoholes sus propiedades físicas características, y el alquilo es el que las modifica, dependiendo de su tamaño y forma.El grupo –OH es muy polar y, lo que es más importante, es capaz de establecer puentes de hidrógeno: con sus moléculas compañeras o con otras moléculas neutras.
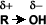
Solubilidad:
Puentes de hidrógeno: La formación de puentes de hidrógeno permite la asociación entre las moléculas de alcohol. Los puentes de hidrógeno se forman cuando los oxígenos unidos al hidrógeno en los alcoholes forman uniones entre sus moléculas y las del agua. Esto explica la solubilidad del metanol, etanol, 1-propanol, 2-propanol y 2 metil-2-propanol.
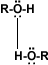
alcohol-alcohol
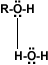
alcohol-agua
Existen alcoholes con múltiples moléculas de OH (polihidroxilados) que poseen mayor superficie para formar puentes de hidrógeno, lo que permiten que sean bastante solubles en agua.
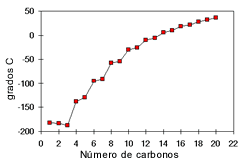
Punto de Ebullición:
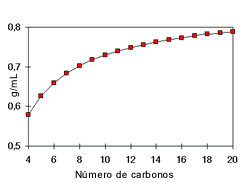
Los puntos de ebullición de los alcoholes también son influenciados por la polaridad del compuesto y la cantidad de puentes de hidrógeno. Los grupos OH presentes en un alcohol hacen que su punto de ebullición sea más alto que el de los hidrocarburos de su mismo peso molecular. En los alcoholes el punto de ebullición aumenta con la cantidad de átomos de carbono y disminuye con el aumento de las ramificaciones.
El punto de fusión aumenta a medida que aumenta la cantidad de carbonos.
ETERES
.jpg)
Debido a que el ángulo del enlace C-o-C no es de 180º, los momentos dipolares de los dos enlaces C-O no se anulan; en consecuencia, los éteres presentan un pequeño momento dipolar neto (por ejemplo, 1.18 D para el dietil éter).
Esta polaridad débil no afecta apreciablemente a los puntos de ebullición de los éteres, que son similares a los de los alcanos de pesos moleculares comparables y mucho más bajos que los de los alcoholes isómeros. Comparemos, por ejemplo, los puntos de ebullición del n-heptano (98ºC), el metil n-pentil éter (100ºC) y el alcohol hexílico (157ºC). Los puentes de hidrógeno que mantienen firmemente unidas las moléculas de alcoholes no son posibles para los éteres, pues éstos sólo tienen hidrógeno unido a carbono.
Por otra parte, los éteres presentan una solubilidad en agua comparable a la de los alcoholes: tanto el dietil éter como el alcohol n-butílico, por ejemplos, tienen una solubilidad de unos 8 g por 100g de agua. La solubilidad de los alcoholes inferiores se debe a los puentes de hidrógeno entre moléculas de agua y de alcohol; es probable que la solubilidad de los éteres en agua se debe a la misma causa.
ESTERES
El éter metílico (P.e. -24°C) y el éter metil etílico (P.e. 8°C) son gases a temperatura normal. Ya el éter etílico (P.e. 35°C) es un líquido muy volátil. Los éteres con cadenas carbonadas mayores van teniendo mayor punto de ebullición a medida que aumenta la longitud de la cadena.
Los éteres de cadena recta tiene un punto de ebullición bastante similar a los alcanos con peso molecular comparable. Por ejemplo: el éter C2-H5-O-C2-H5, con peso molecular 74 tiene un punto de ebullición de 35°C, y el alcano CH3-CH2-CH2-CH2-CH3 de peso molecular 72 tiene un punto de ebullición de 36°C.
Los éteres tienen una solubilidad en agua comparable con los alcoholes para peso molecular similar, así el éter C2-H5-O-C2-H5 tiene la misma solubilidad que el alcohol CH3-CH2-CH2-CH2-OH unos 8g/100ml de agua a 25°C.
Al tratarse de compuestos moleculares (líquidos volátiles o sólidos) sus propiedades físicas más representativas son:
Aislantes eléctricos en fusión y en disolución.
Bajo temperatura de fusión y ebullición que crece con la masa molar. Las propiedades físicas y químicas de los ésteres de bajo peso molecular corresponden, en general, a una combinación de las propiedades de los dos grupos. Al aumentar el peso molecular, la parte de hidrocarburo de la molécula tiene un efecto preponderante sobre las funciones oxigenadas, razón por la cual los ésteres superiores son ceras sólidas, blandas e insolubles en agua.
Según la longitud de la cadena hidrocarbonada serán más o menos solubles en agua y más o menos solubles en disolventes orgánicos (hexano, éter, benceno, acetona…)
A causa del número extraordinariamente elevado de ácidos y alcoholes que pueden utilitzarse en la reacción de esterificación, se han preparado y estudiado miles de ésteres, desde el más sencillo (HCOOCH3, formiato de metilo), hasta los compuestos de peso molecular más elevado que contienen 30 o más átomos de carbono en ambas partes de la molécula. PROPIEDADES QUÍMICAS DE LOS ALCOHOLES, ETERES, ESTERES
ALCOHOLES
Los alcoholes pueden comportarse como ácidos o bases, esto gracias al efecto inductivo, que no es más que el efecto que ejerce la molécula de –OH como sustituyente sobre los carbonos adyacentes. Gracias a este efecto se establece un dipolo.La estructura del alcohol está relacionada con su acidez. Los alcoholes, según su estructura pueden clasificarse como metanol, el cual presenta un sólo carbono, alcoholes primarios, secundarios y terciarios que presentan dos o más moléculas de carbono.
Alcohol Terciario
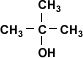
2-metil-2-propanol
Alcohol Secundario
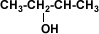
2-butanol
Alcohol Primario
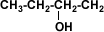
1-butanol
Metanol
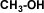
Debido a que en el metanol y en los alcoholes primarios el hidrógeno está menos firmemente unido al oxígeno, la salida de los protones de la molécula es más fácil por lo que la acidez será mayor en el metanol y el alcohol primario.
.
ÉTER
Los éteres tienen muy poca reactividad química, debido a la dificultad que presenta la ruptura del enlace C—O. Por ello, se utilizan mucho como disolventes inertes en reacciones orgánicas. En contacto con el aire sufren una lenta oxidación en la que se forman peróxidos muy inestables y poco volátiles. Estos constituyen un peligro cuando se destila un éter, pues se concentran en el residuo y pueden dar lugar a explosiones. Esto se evita guardando el éter con hilo de sodio o añadiendo una pequeña cantidad de un reductor (SO4Fe, LiAIH4) antes de la destilación .REACCIONES
Los éteres no son reactivos a excepción de los epóxidos.Las reacciones de los epóxidos pasan por la apertura del ciclo.Dicha apertura puede ser catalizada por ácido o apertura mediante nucleófilo.
ESTERES
En las reacciones de los ésteres, la cadena se rompe siempre en un enlace sencillo, ya sea entre el oxígeno y el alcohol o R, ya sea entre el oxígeno y el grupo R-CO-, eliminando así el alcohol o uno de sus derivados.
La saponificación de los ésteres, llamada así por su analogía con la formación de jabones a partir de las grasas, es la reacción inversa a la esterificación: Los ésteres se hidrogenan más fácilmente que los ácidos, empleándose generalmente el éster etílico tratado con una mezcla de sodio y alcohol, y se condensan entre sí en presencia de sodio y con las cetonas.
Los ésteres son el producto de la deshidratación entre una molécula de ácido y una de alcohol. Para nombrarlos se cambia la terminación ico del nombre del ácido por el sufijo ato y el nombre del radical derivado del alcohol, o bien el nombre del metal en el caso de las sales orgánicas.
USOS DE LOS ALCOHOLES , ÉTER Y ESTERES
ALCOHOLES

Los alcoholes se utilizan como productos químicos intermedios y disolventes en las industrias de textiles, colorantes, productos químicos, detergentes, perfumes, alimentos, bebidas, cosméticos, pinturas y barnices. Algunos compuestos se utilizan también en la desnaturalización del alcohol, en productos de limpieza, aceites
y tintas de secado rápido, anticongelantes, agentes espumígenos y en la flotación de minerales.
El n-propanol es un disolvente utilizado en lacas, cosméticos,lociones dentales, tintas de impresión, lentes de contacto y líquidos de frenos. También sirve como antiséptico, aromatizante sintético de bebidas no alcohólicas y alimentos, producto químico intermedio y desinfectante.
El isopropanol es otro disolvente industrial importante que se utiliza como anticongelante, en aceites y tintas de secado rápido, en la des naturalización de alcoholes y en perfumes. Se emplea como antiséptico y sustitutivo del alcohol etílico en cosméticos (p. ej. lociones para la piel, tónicos capilares y alcohol para fricciones), pero no puede utilizarse en productos farmacéuticos aplicados internamente.
El isopropanol es un ingrediente de jabones líquidos, limpiacristales, aromatizante sintético de bebidas no alcohólicas y alimentos y producto químico intermedio. El n-butanol se emplea como disolvente de pinturas, lacas, barnices, resinas naturales y sintéticas, gomas, aceites vegetales, tintes y alcaloides. Se utiliza como sustancia intermedia en lafabricación de productos químicos y farmacéuticos, y en las industrias de cuero artificial, textiles, gafas de seguridad, pastasde caucho, barnices de laca, impermeables, películas fotográficas y perfumes.
El sec-butanol se utiliza también como disolvente y
producto químico intermedio, y se encuentra en líquidos hidráulicos de frenos, limpiadores industriales, abrillantadores, decapantes de pinturas, agentes de flotación para minerales, esencias
de frutas, perfumes y colorantes.
El isobutanol , un disolvente para revestimientos de superficie y adhesivos, se emplea en lacas, decapantes de pinturas, perfumes, productos de limpieza y líquidos hidráulicos. El terc-butanol se
utiliza para la eliminación del agua de los productos, como disolvente en la fabricación de fármacos, perfumes y aromas, y como producto químico intermedio. También es un ingrediente de productos industriales de alcohol, un desnaturalizante de alcoholes y un cebador de octano en gasolinas. Los alcoholes amílicos
actúan como espumígenos en la flotación de minerales.
ETERES

Medio para extractar para concentrar ácido acético y otros ácidos.
- Medio de arrastre para la deshidratación de alcoholes etílicos e isopropílicos.
- Disolvente de sustancias orgánicas (aceites, grasas, resinas, nitrocelulosa, perfumes y alcaloides).
- Combustible inicial de motores Diésel.
- Fuertes pegamentos
- Desinflamatorio abdominal para despues del parto, exclusivamente uso externo.
-Es llamado la medicina antigua porque en la antiguedad se usaba como anestesico, debido a que no existian los metodos de anestesia moderna.
El Éter Narcosis se expende en frascos de vidrios de 100 grs. con tapa rosca, contratapa de polietileno de alta densidad y embalado en cajas de cartón para 50 unidades.
El Éter Puro es envasado en botella de color ámbar de 700 grs. con tapa rosca y contratapa de polietileno de alta densidad y embalado en cajas de cartón para 9 unidades.
El Éter Industrial es envasado en botella de color ámbar de 700 grs. con tapa rosca y contratapa de polietileno de alta densidad, embalada en cajas de cartón para 9 unidades y también es envasado en tambores de acero galvanizados de 200 litros.
Es un producto líquido a temperatura ambiente, muy volátil y extremadamente inflamable. Es incoloro de olor purgente dulce. Se usa como medio de reacción, disolvente, agente extractivo y anestésico general.
ESTERES
Muchos ésteres tienen un olor característico, lo que hace que se utilicen ampliamente como sabores y fragancias artificiales. Por ejemplo:
* metil butanoato: olor a piña
* metil salicilato (aceite de siempreverde): olor de las pomadas Germolene™ y Ralgex™ (Reino Unido)
* etil metanoato: olor a frambuesa
* pentil etanoato: olor a plátano
* pentil pentanoato: olor a manzana
* pentil butanoato: olor a pera o a albaricoque
* octil etanoato: olor a naranja.
Los ésteres también participan en la hidrólisis esterárica: la ruptura de un éster por agua. Los ésteres también pueden ser descompuestos por ácidos o bases fuertes. Como resultado, se descomponen en un alcohol y un ácido carboxílico, o una sal de un ácido carboxílico.
Los ésteres son empleados en muchos y variados campos del comercio y de la industria, como los siguientes:
DisolventesLos ésteres de bajo peso molecular son líquidos y se acostumbran a utilizar como disolventes, especialmente los acetatos de los alcoholes metílico, etílico y butílico.
PlastificantesEl acetatopropionato de celulosa y el acetatobutirato de celulosa han conseguido gran importancia como materiales termoplásticos. El nitrato de celulosa con un contenido de 10,5-11% de nitrógeno se llama piroxilina y con alcohol y alcanfor (plastificante) forma el celuloide. El algodón dinamita es nitrato de celulosa con el 12,5-13,5% de nitrógeno. La cordita y la balistita se fabrican a partir de éste, que se plastifica con trinitrato de glicerina (nitroglicerina). Los sulfatos de dimetilo y dietilo (ésteres del ácido sulfúrico) son excelentes agentes de alcoholización de moléculas orgánicas que contienen átomos de hidrógeno lébiles, como por ejemplo, el midón y la celulosa.
Aromas artificialesMuchos de los ésteres de bajo peso molecular tienen olores característicos a fruta: plátano (acetado de isoamilo), ron (propionato de isobutilo) y piña (butirato de butilo). Estos ésteres se utilizan en la fabricación de aromas y perfumes sintéticos.
Aditivos AlimentariosEstos mismos ésteres de bajo peso molecular que tienen olores característicos a fruta se utilizan como aditivos alimentarios, por ejemplo, en caramelos y otros alimentos que han de tener un sabor afrutado.
Productos FarmacéuticosProductos de uso tan frecuente como los analgésicos se fabrican con ésteres.
Polímeros DiversosLos ésteres de los ácidos no saturados, por ejemplo, del ácido acrílico o metacrílico, son inestables y se polimerizan rápidamente, produciendo resina; así, el metacrilato de metilo (lucita o plexiglás). De manera análoga los ésteres de los alcoholes no saturados son inestables y reaccionan fácilmente con ellos mismos; así, el acetado de vinilo se polimeriza dando acetato de polivinilo. Las resinas de poliéster, conocidas como gliptales, resultan de la poliesterificación de la glicerina con anhídrido ftálico; el proceso puede controlarse de manera que se produzca una resina fusible o infusible. Cuando la poliesterificación se realiza en presencia de un ácido no saturado de cadena larga del tipo de los aceites secantes, la polimerización de éste por oxidación se superpone a la poliesterificación y se producen los esmaltes sintéticos, duros y resistentes a la intemperie, que son muy adecuados por el acabado de los automóviles. La poliesterificación del etilenglicol con el ácido tereftálico produce fibra de poliéster. Si se da forma de láminas a este material, constituye una excelente película fotográfica.
Repelentes de insectosTodos los repelentes de insectos que podemos encontrar en el mercado contienen ésteres.
BENEFICIOS Y RIESGOS PARA LA SALUD DE LOS ALCOHOLES ,ETERES Y ESTERES
.jpg)
ALCOHOLES
METANOL
El alcohol de madera, alcohol metílico o metanol, de fórmula CH3OH, es el más simple de los alcoholes. Antes se preparaba por destilación destructiva de la madera, pero hoy en día casi todo el metanol producido es de origen sintético, elaborado a partir de hidrógeno y monóxido de carbono. El metanol se utiliza para desnaturalizar alcohol etílico, como anticongelante, disolvente para gomas y lacas, así como en la síntesis de compuestos orgánicos como el metanal (formaldehído). Al ser ingerido en forma líquida o inhalado en vapor, el metanol puede resultar peligroso. Tiene un punto de fusión de
-97,8 °C y un punto de ebullición de 64,7 °C. Su densidad relativa es de 0,7915 a 20 °C.
ETANOL
El alcohol de vino, alcohol etílico o etanol, de fórmula C2H5OH, es un líquido transparente e incoloro, con sabor a quemado y un olor agradable característico. Es el alcohol que se encuentra en bebidas como la cerveza, el vino y el brandy. Debido a su bajo punto de congelación, ha sido empleado como fluido en termómetros para medir temperaturas inferiores al punto de congelación del mercurio, -40°C, y como anticongelante en radiadores de automóviles.
Normalmente el etanol se concentra por destilación de disoluciones diluidas. El de uso comercial contiene un 95% en volumen de etanol y un 5% de agua. Ciertos agentes deshidratantes extraen el agua residual y producen etanol absoluto. El etanol tiene un punto de fusión de -114,1 °C, un punto de ebullición de 78,5 °C y una densidad relativa de 0,789 a 20 °C.
Desde la antigüedad, el etanol se ha obtenido por fermentación de azúcares. Todas las bebidas con etanol y casi la mitad del etanol industrial aún se fabrican mediante este proceso. El almidón de la patata (papa), del maíz y de otros cereales constituye una excelente materia prima. La enzima de la levadura, la cimasa, transforma el azúcar simple en dióxido de carbono. La reacción de la fermentación, representada por la ecuación
C6H12O6 ! 2C2 H5OH + 2CO2
Es realmente compleja, ya que los cultivos impuros de levaduras producen una amplia gama de otras sustancias, como el aceite de fusel, la glicerina y diversos ácidos orgánicos. El líquido fermentado, que contiene de un 7 a un 12% de etanol, se concentra hasta llegar a un 95% mediante una serie de destilaciones. En la elaboración de ciertas bebidas como el whisky y el brandy, algunas de sus impurezas son las encargadas de darle su característico sabor final. La mayoría del etanol no destinado al consumo humano se prepara sintéticamente, tanto a partir del etanal (acetaldehído) procedente del etino (acetileno), como del eteno del petróleo. También se elabora en pequeñas cantidades a partir de la pulpa de madera.
La oxidación del etanol produce etanal que a su vez se oxida a ácido etanoico. Al deshidratarse, el etanol forma dietiléter. El butadieno, utilizado en la fabricación de caucho sintético, y el cloroetano, un anestésico local, son otros de los numerosos productos químicos que se obtienen del etanol. Este alcohol es miscible (mezclable) con agua y con la mayor parte de los disolventes orgánicos. Es un disolvente eficaz de un gran número de sustancias, y se utiliza en la elaboración de perfumes, lacas, celuloides y explosivos. Las disoluciones alcohólicas de sustancias no volátiles se denominan tinturas. Si la disolución es volátil recibe el nombre de espíritu.
ALCOHOLES SUPERIORES
Los alcoholes superiores, de mayor masa molecular que el etanol, tienen diversas aplicaciones tanto específicas como generales: el propanol se usa como alcohol para frotar y el butanol como base para perfumes y fijadores. Otros constituyen importantes condimentos y perfumes.
Metanol
En la antigüedad el Metanol se obtenía por destilación seca de la madera. Actualmente se prepara en grandes cantidades por catalítica del monóxido de carbono:
Co + H2 H-CH2-OH
El Metanol no se utiliza en bebidas Alcohólicas, debido a su poder de Toxicidad.
El Alcohol Etílico es el apropiado para la fabricación de bebidas alcohólicas., Con el fin de que no sirva para la preparación de bebidas.
EFECTOS DE ALGUNOS ALCOHOLES AL ENTRAR EN CONTACTO CON EL CUERPO HUMANO.
ALCOHOL ETÍLICO (ETANOL).
El alcohol se absorbe en estómago (un 20% en ayuno) y el máximo en sangre aparece a los 40-45 minutos. La comida retarda la absorción en el tubo digestivo. El alcohol tarda de 10-30 horas en desaparecer de la sangre.
El metabolismo es:
Alcohol alcohol deshidrogenasas acetaldehído.
Acetaldehído alcohol deshidrogenasa ácido acético.
La sintomatología a dosis elevadas y repetidas es de hepatotóxico y neurotóxico potente.
1. Sedación, distensión psíquica.
2. Euforia.
3. Alteración de la sensación dolorosa.
4. Alteración de la coordinación muscular.
5. Narcosis.
6. Hiperventilación.
7. Sensación de angustia.
8. Pérdida de reflejos.
9. Parálisis de la respiración y muerte muy difícil porque provoca vómito.
El etanol es uno de los productos que más contraindicaciones tiene.
DISOLVENTES Y SUSTANCIAS AFINES
Productos usados preferentemente como disolventes o como diluyentes, pero también como compuestos de partida para la síntesis de otros productos combustibles, anticoagulantes, aromatizantes, bebidas, fármacos...
Hidrocarburos alifáticos pentano, hexano (muy tóxico porque se metaboliza en 2,3-hexanodiona neurotóxico muy potente), heptano, octano, etilén, acetileno...
Hidrocarburos alicíclicos ciclopropano, ciclohexano (muy tóxico porque se metaboliza en 2,3-hexanodiona neurotóxico muy potente)...
Hidrocarburos aromáticos benceno (anillo principal aromático, es carcinógeno, lo lleva más la gasolina sin plomo), tolueno, xileno...
Hidrocarburos halogenados cloroformo, tricloroetileno, tetracloruro de C (disolvente de productos en seco), halotano, enfluorane (muy buenos disolventes pero muy problemáticos).
Cetonas acetona.
Éter éter dietílico (buen disolvente y anestésico). Muy explosivo. Punto de ebullición de 35ºC.
Alcoholes metanol, etanol, n-propanol, isopropanol, etilenglicol, fenol...
Aldehídos formaldehído, acetaldehído...
Nitrilos acetonitrilo...
ALQUITRÁN
Muy variable. 50% betún y 50% otros compuestos como el benceno, tolueno, xilenos, naftalenos, fenoles, cresoles y amoniacos.
Les gusta mucho a los cerdos. También a los gatos (muy susceptible para la glucoronoconjugación).
La sintomatología que produce es anorexia, depresión, debilidad, ictericia, taquipnea y muerte.
Los esnifadores de cola usaban el benceno y, ahora, el tolueno.
FENOLES Y CRESOLES
Usados como desinfectantes, ungüentos, preservación de la madera (palos de electricidad y teléfonos, traviesas de la vía...).
Afecta a gatos principalmente.
La sintomatología es depresión, vómitos, incoordinación, convulsiones, coma y muerte.
El tratamiento consiste en emesis o lavado gástrico, glucosa salina IV, estimulantes del sistema nervioso...
Tiene mal pronóstico.
HIDROCARBUROS AROMÁTICOS POLICÍCLICOS
Sobre todo se forman en la combustión de materia orgánica, volcanes, incendios forestales, alimentos ahumados o alimentos sometidos a altas temperaturas, motores de combustión interna, tabaco (sobre todo benzopireno).
Necesitan la activación metabólica.
Son carcinógenos.
No es recomendable basar la dieta en estos productos.
DAÑOS AL CUERPO
Inhalación: Altas concentraciones de vapores de metanol pueden causar la muerte.
El primer síntoma de envenenamiento con Metanol es la ceguera ya que daña el nervio óptico.
El Etanol, es la droga más antigua usada por el hombre, es una de las drogas que provoca mas dependencia afectando principalmente al hígado. El Alcohólico sufre una variación biológica cualitativa de la respuesta del sistema nervioso.
Sistema Digestivo: Irrita la mucosa del esófago, el estomago, y el intestino cuyas funciones digestivas altera. También puede originar diarrea crónica y cirrosis hepática, enfermedad en la cual el tejido normal del hígado es reemplazado por cicatrices fibrosas que impiden el cumplimiento de las importantes funciones de este órgano.
Sistema Respiratorio: Causa neumonías, abscesos pulmonares.
Sistema Circulatorio: produce insuficiencia cardiaca, alteraciones del ritmo de sus latidos, agrandamiento del corazón e hipertensión. Disminuye la actividad de los leucocitos y la resistencia de las enfermedades.
Sistema Muscular: origina inflamaciones y calambres.
Sistema Nervioso: provoca desinhibiciones, lentitud en los reflejos, incoordinación muscular, dificultades en la memoria, desorientación en el tiempo y espacio. Además ocasiona modificaciones en el carácter, con periodos de tristeza, de pereza, de irritabilidad y de violencia, pesadillas, alucinaciones nocturnas especialmente relacionadas con precipicios y con animales, monstruos que lo atacan.
En la piel: causa dilatación capilar y le da un color rojo oscuro y un aspecto rugoso en la cara, especialmente en la nariz.
En la visión: la alcoholemia excesiva estecla el campo visual, que normalmente es de uno 180º. Provoca así la “visión túnel” que impide al conductor percibir los vehículos las personas que se aproximen a ambos lados trasversales.
El Metanol, se utiliza como disolvente, anticongelante, desnaturalizante del “alcohol de quemar” y para la fabricaron de barnices, plásticos, y otros compuestos orgánicos. Hace un tiempo se experimento que con dosis muy pequeñas de Metanol disueltas en agua se obtiene muchos beneficios en plantas de clasificación C3 y en condiciones de cálidas y soleadas. Esta solución facilitaba el crecimiento de cosechas más frecuentes y mayores, minimizaba el uso de agua en el riego y una reducción en el uso de plaguicidas
El Etanol, además de utilizarse para la producción de bebidas alcohólicas, su fin esta destinado a el uso industrial y se emplea como disolvente en farmacia, perfumería y en compuestos orgánicos.
El Propanol, se utiliza como un antiséptico aún más eficaz que el alcohol etílico; es usado como un disolvente importante, su uso ams común es en forma de quitaesmalte. Además se utiliza como desnaturalizante, generalmente mezclado con otros compuestos.
ETER
El doctor norteamericano M. D. Crawford Williamson Long fue el primer cirujano que lo empleó como anestésico general el 30 de marzo de 1842. Sin embargo, su autoría es discutida, no introdujo la anestesia de forma general en su práctica ni escribió ni conferenció sobre el tema antes de que los dentistas Horace Wells yWilliam Morton hicieran sus demostraciones. Los historiadores de la medicina se decantan por estos últimos como verdaderos desarrolladores de la anestesia. El éter no se usa mientras haya otro anestésico disponible, por su inflamabilidad y porque es irritante para algunos pacientes.
Debido a esas razones, junto con su alta inflamabilidad y su bajo punto de ignición, el éter etílico es considerado como uno de los factores de riesgo de los laboratorios.
El éter puede usarse para anestesiar garrapatas antes de eliminarlas de un cuerpo animal o humano. La anestesia relaja a la garrapata y evita que mantenga su boca debajo de la piel.
¿Que beneficios y riesgos tienen los esteres para la salud?
Los disolventes y las tintas son los productos químicos que con mas frecuencia se utilizan el Sector de Artes de Gráficas, dado que alguno de estos productos pueden ser sumamente peligrosos para la salud y hasta mortales
cuando se utilizan sin las precauciones adecuadas, el conocimiento previo
de los riesgos que conlleva su utilización, así como un sistema eficaz de
seguridad y salud constituyen la mejor prevención y protección de los trabajadores frente a éstos riesgos.
http://s.wikipedia.org/wiki/%C3%89ter_et%C3%ADlico
http://html.rincondelvago.com/eteres.html
http://espanol.answers.yahoo.com/question/index?qid=20061031104737AATESQa
http://kira2629.wordpress.com/2009/06/20/propiedades-fisicas-y-quimicas-de-los-esteres/
http://www.sabelotodo.org/quimica/eteres.html
http://espanol.answers.yahoo.com/question/index?qid=20090120183349AALZhAb
http://www.salonhogar.net/quimica/nomenclatura_quimica/Propiedades_alcoholes.htm
http://www.facmed.unam.mx/deptos/salud/censenanza/spivst/2012/104-03.pdf
http://es.answers.yahoo.com/question/index?qid=20071128192217AAi4VVG
http://espanol.answers.yahoo.com/question/index?qid=20070412150022AAaPVNo
http://www.galeon.com/cheko/aplica.html
http://html.rincondelvago.com/alcoholes_3.html
Alcohol alcohol deshidrogenasas acetaldehído.
Acetaldehído alcohol deshidrogenasa ácido acético.
La sintomatología a dosis elevadas y repetidas es de hepatotóxico y neurotóxico potente.
1. Sedación, distensión psíquica.
2. Euforia.
3. Alteración de la sensación dolorosa.
4. Alteración de la coordinación muscular.
5. Narcosis.
6. Hiperventilación.
7. Sensación de angustia.
8. Pérdida de reflejos.
9. Parálisis de la respiración y muerte muy difícil porque provoca vómito.
El etanol es uno de los productos que más contraindicaciones tiene.
DISOLVENTES Y SUSTANCIAS AFINES
Productos usados preferentemente como disolventes o como diluyentes, pero también como compuestos de partida para la síntesis de otros productos combustibles, anticoagulantes, aromatizantes, bebidas, fármacos...
Hidrocarburos alifáticos pentano, hexano (muy tóxico porque se metaboliza en 2,3-hexanodiona neurotóxico muy potente), heptano, octano, etilén, acetileno...
Hidrocarburos alicíclicos ciclopropano, ciclohexano (muy tóxico porque se metaboliza en 2,3-hexanodiona neurotóxico muy potente)...
Hidrocarburos aromáticos benceno (anillo principal aromático, es carcinógeno, lo lleva más la gasolina sin plomo), tolueno, xileno...
Hidrocarburos halogenados cloroformo, tricloroetileno, tetracloruro de C (disolvente de productos en seco), halotano, enfluorane (muy buenos disolventes pero muy problemáticos).
Cetonas acetona.
Éter éter dietílico (buen disolvente y anestésico). Muy explosivo. Punto de ebullición de 35ºC.
Alcoholes metanol, etanol, n-propanol, isopropanol, etilenglicol, fenol...
Aldehídos formaldehído, acetaldehído...
Nitrilos acetonitrilo...
ALQUITRÁN
Muy variable. 50% betún y 50% otros compuestos como el benceno, tolueno, xilenos, naftalenos, fenoles, cresoles y amoniacos.
Les gusta mucho a los cerdos. También a los gatos (muy susceptible para la glucoronoconjugación).
La sintomatología que produce es anorexia, depresión, debilidad, ictericia, taquipnea y muerte.
Los esnifadores de cola usaban el benceno y, ahora, el tolueno.
FENOLES Y CRESOLES
Usados como desinfectantes, ungüentos, preservación de la madera (palos de electricidad y teléfonos, traviesas de la vía...).
Afecta a gatos principalmente.
La sintomatología es depresión, vómitos, incoordinación, convulsiones, coma y muerte.
El tratamiento consiste en emesis o lavado gástrico, glucosa salina IV, estimulantes del sistema nervioso...
Tiene mal pronóstico.
HIDROCARBUROS AROMÁTICOS POLICÍCLICOS
Sobre todo se forman en la combustión de materia orgánica, volcanes, incendios forestales, alimentos ahumados o alimentos sometidos a altas temperaturas, motores de combustión interna, tabaco (sobre todo benzopireno).
Necesitan la activación metabólica.
Son carcinógenos.
No es recomendable basar la dieta en estos productos.
DAÑOS AL CUERPO
Inhalación: Altas concentraciones de vapores de metanol pueden causar la muerte.
El primer síntoma de envenenamiento con Metanol es la ceguera ya que daña el nervio óptico.
El Etanol, es la droga más antigua usada por el hombre, es una de las drogas que provoca mas dependencia afectando principalmente al hígado. El Alcohólico sufre una variación biológica cualitativa de la respuesta del sistema nervioso.
Sistema Digestivo: Irrita la mucosa del esófago, el estomago, y el intestino cuyas funciones digestivas altera. También puede originar diarrea crónica y cirrosis hepática, enfermedad en la cual el tejido normal del hígado es reemplazado por cicatrices fibrosas que impiden el cumplimiento de las importantes funciones de este órgano.
Sistema Respiratorio: Causa neumonías, abscesos pulmonares.
Sistema Circulatorio: produce insuficiencia cardiaca, alteraciones del ritmo de sus latidos, agrandamiento del corazón e hipertensión. Disminuye la actividad de los leucocitos y la resistencia de las enfermedades.
Sistema Muscular: origina inflamaciones y calambres.
Sistema Nervioso: provoca desinhibiciones, lentitud en los reflejos, incoordinación muscular, dificultades en la memoria, desorientación en el tiempo y espacio. Además ocasiona modificaciones en el carácter, con periodos de tristeza, de pereza, de irritabilidad y de violencia, pesadillas, alucinaciones nocturnas especialmente relacionadas con precipicios y con animales, monstruos que lo atacan.
En la piel: causa dilatación capilar y le da un color rojo oscuro y un aspecto rugoso en la cara, especialmente en la nariz.
En la visión: la alcoholemia excesiva estecla el campo visual, que normalmente es de uno 180º. Provoca así la “visión túnel” que impide al conductor percibir los vehículos las personas que se aproximen a ambos lados trasversales.
El Metanol, se utiliza como disolvente, anticongelante, desnaturalizante del “alcohol de quemar” y para la fabricaron de barnices, plásticos, y otros compuestos orgánicos. Hace un tiempo se experimento que con dosis muy pequeñas de Metanol disueltas en agua se obtiene muchos beneficios en plantas de clasificación C3 y en condiciones de cálidas y soleadas. Esta solución facilitaba el crecimiento de cosechas más frecuentes y mayores, minimizaba el uso de agua en el riego y una reducción en el uso de plaguicidas
El Etanol, además de utilizarse para la producción de bebidas alcohólicas, su fin esta destinado a el uso industrial y se emplea como disolvente en farmacia, perfumería y en compuestos orgánicos.
El Propanol, se utiliza como un antiséptico aún más eficaz que el alcohol etílico; es usado como un disolvente importante, su uso ams común es en forma de quitaesmalte. Además se utiliza como desnaturalizante, generalmente mezclado con otros compuestos.
ETER
El doctor norteamericano M. D. Crawford Williamson Long fue el primer cirujano que lo empleó como anestésico general el 30 de marzo de 1842. Sin embargo, su autoría es discutida, no introdujo la anestesia de forma general en su práctica ni escribió ni conferenció sobre el tema antes de que los dentistas Horace Wells yWilliam Morton hicieran sus demostraciones. Los historiadores de la medicina se decantan por estos últimos como verdaderos desarrolladores de la anestesia. El éter no se usa mientras haya otro anestésico disponible, por su inflamabilidad y porque es irritante para algunos pacientes.
Debido a esas razones, junto con su alta inflamabilidad y su bajo punto de ignición, el éter etílico es considerado como uno de los factores de riesgo de los laboratorios.
El éter puede usarse para anestesiar garrapatas antes de eliminarlas de un cuerpo animal o humano. La anestesia relaja a la garrapata y evita que mantenga su boca debajo de la piel.
¿Que beneficios y riesgos tienen los esteres para la salud?
Los disolventes y las tintas son los productos químicos que con mas frecuencia se utilizan el Sector de Artes de Gráficas, dado que alguno de estos productos pueden ser sumamente peligrosos para la salud y hasta mortales
cuando se utilizan sin las precauciones adecuadas, el conocimiento previo
de los riesgos que conlleva su utilización, así como un sistema eficaz de
seguridad y salud constituyen la mejor prevención y protección de los trabajadores frente a éstos riesgos.
http://s.wikipedia.org/wiki/%C3%89ter_et%C3%ADlico
http://html.rincondelvago.com/eteres.html
http://espanol.answers.yahoo.com/question/index?qid=20061031104737AATESQa
http://kira2629.wordpress.com/2009/06/20/propiedades-fisicas-y-quimicas-de-los-esteres/
http://www.sabelotodo.org/quimica/eteres.html
http://espanol.answers.yahoo.com/question/index?qid=20090120183349AALZhAb
http://www.salonhogar.net/quimica/nomenclatura_quimica/Propiedades_alcoholes.htm
http://www.facmed.unam.mx/deptos/salud/censenanza/spivst/2012/104-03.pdf
http://es.answers.yahoo.com/question/index?qid=20071128192217AAi4VVG
http://espanol.answers.yahoo.com/question/index?qid=20070412150022AAaPVNo
http://www.galeon.com/cheko/aplica.html
http://html.rincondelvago.com/alcoholes_3.html

.jpg)